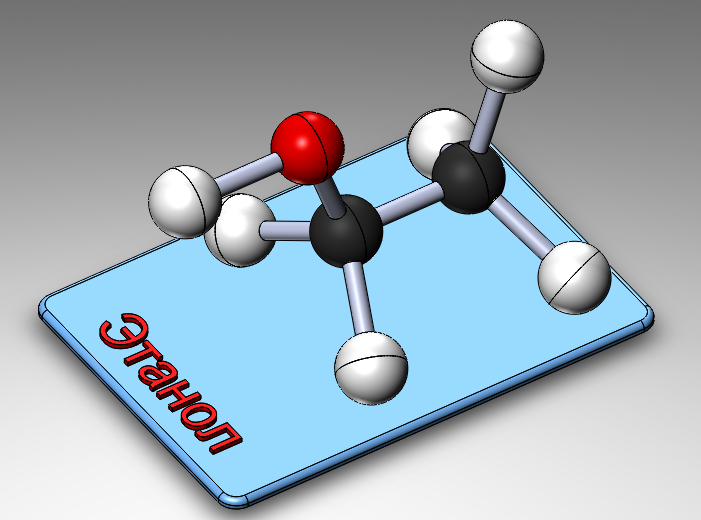
Несложные способы отличить этил и метил
![]()
Самым простым способом, как определить метиловый спирт в алкоголе есть погружение в жидкость обчищенного картофеля. Если за пол часа картофель приобретет розовый оттенок, вполне вероятно он контактировал с метанолом. В случае, если изменение цвета не произойдет или картофель станет синим, алкоголь содержит определенный процент этила.
Отличить метиловый спирт от этилового можно с помощью марганцовки. Спирт в домашних условиях наливают в емкость, что можно нагревать. Добавляют немного марганцовки и нагревают до 18 градусов. Далее необходимо засекать время изменения цвета жидкости. Она может окраситься цветом от фиолетового до желто-розового. Проба считается пройденной, и в емкости алкоголь с этанолом, если обесцвечивание выявили не раньше, чем за 10 минут.
Среди других, не менее простых способов, как отличить метанол от этанола можно отметить такие эксперименты:
- Отличие между этиловыми вариантами алкоголя и спирте метаноле можно увидеть, если нагреть жидкость. Технические спирты температуру кипения имеют ниже. То есть в метиловом варианте можно обнаружить кипение при 64 градусах, а этиловому спирту нужна большая температура, примерно 78 градусов.
- Оговаривая чем отличается этиловый спирт от метилового, нельзя забыть и о школьном эксперименте с химии. В холодную жидкость погружают нагретую медную проволоку. Если в процессе реакции меди, ощущается запах прелых яблок или определяем запах уксуса, то проволока контактировала с этиловым спиртом. Разницу ощущают практически сразу, когда опускают тот же медный провод в емкость с алкоголем на основе метила. Будет ощущаться едкий запах формалина.
- Как определить этиловый спирт знают повара, они добавляют в жидкость немного пищевой соды, если на дне появляется нерастворимый густой желтый осадок, то сода была опущена в этил. Опустив соду в метиленовую жидкость, осадок будет белым или прозрачным.
- Отличать метил можно с помощью марганцовки, если добавить ее небольшое количество в процессе кипения жидкости, разница будет в том, что этил не образует пузырьков, а вот метил образует.
Если вы хотите сохранить свое здоровье на протяжении длительного времени, лучше вовсе отказаться от употребления горячительных напитков, и не искать отличий между «плохим» и «еще хуже». Между горячительным нет большой разницы, этил убивает человека медленно, разрушая внутренние органы, а метил отличим тем, что убивает мгновенно. И в первом, и во втором спиртовом напитке — ждет смерть, помните это, и ведите здоровый образ жизни.
[править] Ссылки
| (0°) | Метанол |
|---|---|
| Первичные спирты (1°) |
Этанол · Пропанол · н-Бутанол · Изобутанол · Амиловый спирт · Гексанол · Гептанол
Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16) |
| Вторичные спирты (2°) | Изопропиловый спирт · втор-Бутанол · Гексан-2-ол |
| Третичные спирты (3°) | трет-Бутанол · 2-Метилбутан-2-ол |
| Высокоалкогольные (66—96 %) | Абсент • Спирт • Первач • Штро |
|---|---|
| Крепкие (31—65 %) | Авамори • Аквавит • Арак • Арманьяк • Бальзам • Биттер • Боровичка • Бренди • Бумбо • Буха • Виски (бурбон, скотч) • Водка (Ароматизированная, «Байкал», «Гетман», «Журавли», Путинка, Russian Shot, НМПТ Русская водка) • Граппа • Джин • Дивин • Ерофеич • Женевер • Зубровка • Кальвадос • Кашаса • Киршвассер • Клековача • Коньяк • Крамбамбуля • Крупник • Ламбиг • Ликёр • Маотай • Мескаль • Мараскин • Метакса • Настойка (горькая) • Орухо • Палинка • Писко • Потин • Ракия • Ракы • Ратафия • Ром • Самбука • Самогон • Сетю • Сливовица • Старка • Текила • Тутовка • Узо • Фернет • Чача • Шнапс • Яловийна • The Botanist |
| Среднеалкогольные (9—30 %) | Вермут • Вино • Глинтвейн • Глёг • Грог • Кампари • Крюшон • Ликёр • Малага • Мёд • Мистель • Наливка • Пачаран • Поммо • Портвейн • Пунш • Рецина • Саке • Сангрия • Сётю • Соджу • Туак • Херес • Шампанское (севастопольское) |
| Слабоалкогольные (1,5—8 %) | Алкопоп • Березовица • Боза • Буза • Брага • Душепарка • Квас • Кумыс • Медовуха • Перри • Пиво (Старый мельник, Free Beer, White House Honey Ale) • Пульке • Сбитень • Сидр • Тесгуино • Тодди • Чайный гриб • Чича • Эль |
| Употребление и последствия | Алкоголизм (алкаш, у лесбиянок, у мужчин) • Алкогольный синдром плода • Воздействие на человека • Зависимость числа дебилов от потребления • Запой • Отравление • Употребление Ельциным • Уход в запой |
| Запреты | На ввоз грузинских вин в Россию • Вина из сортов Изабелла и Лидия из-за метанола |
| Лексика | Алаверды • Горько! • Заложить за воротник • Известная русская «слабость» • Напиться как свинья • Прохоров • Для проверки степени опьянения • Тост |
| Разное | Алкотуризм • Бирпак • Выдержка • Вытрезвитель • Зелёный мексиканец • Крепость • Содержание в кефире • Спор за бренд Водка • Текильщица • Фабрикация исследований о пользе красного вина • Щипцы для портвейна |
|
Основные виды органического топлива |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ископаемое |
|
||||||||
| Возобновляемое и биологическое |
Валежник • Дрова • Кизяк • Навоз • Древесный уголь • Этанол • Биодизель • Биоэтанол • Бутанол-1 • Метанол • Свалочный газ • Болотный газ • Биогаз • Биоводород | ||||||||
| Искусственное | Доменный газ • Светильный газ • Коксовый газ • Трет-бутилметиловый эфир • Синтез-газ • Синтетическое топливо • Генераторный газ • Водород • Водоугольное топливо • Пековый кокс | ||||||||
| Разное | Газификация угля |
Безопасность
Дело в том, что этиловый спирт — токсичное соединение. В высоких концентрациях оно оказывает сильное влияние на работу центральной нервной, сердечно-сосудистой и пищеварительной систем
Поэтому очень важно соблюдать правила безопасности при обращении с С2Н5ОН
- Конечно, спирт очень токсичен в высоких концентрациях. Стоит учитывать такую закономерность: чем менее очищен спирт, тем он более вреден. Касается это как употребления внутрь, так и вдыхания паров.
- Этиловый спирт может быть опасен не только при приеме внутрь, но и при вдыхании его паров. При превышении допустимой предельной концентрации паров спирта в воздухе (1 000 мг/м3) возможен ожог и повреждение слизистой верхних дыхательных путей. Поэтому на производстве этанола сотрудники большую часть времени должны находиться в противогазе.
- В случае повреждения дыхательных путей человека нужно вывести на свежий воздух, при необходимости сделать искусственное дыхание. При отравлении спиртом в результате приема внутрь следует промыть желудок водой или раствором соды в концентрации 2 %.
- При воздействии на целостные кожные покровы спирт не оказывает токсичного воздействия. Однако поверхность тела может стать сухой, шелушащейся, с многочисленными трещинами.
- Этиловый спирт достаточно легко воспламеняется, поэтому категорически запрещено подносить его к источнику открытого огня.
- Всем известно, что этиловый спирт можно употреблять внутрь для расслабления. Однако стоит сказать, что злоупотреблять этим нельзя. Дело в том, что этанол очень быстро может вызвать стойкую зависимость у человека, а также изменение психики и сознания.
- Нужно следить за тем, чтобы тара с опасным веществом всегда хранилась вне зоны доступа маленьких детей.
Характерные особенности и отличия спиртов
![]()
Этиловый и метиловый спирт отличаются не только своей химической формулой, но и рядом других характеристик. Алкоголь изготовленный на основе этилового спирта не несет разрушительных последствий, если потреблять его в разумных количествах, можно даже получить определенную пользу, чего не скажешь о действии метилового спирта. Его используют для суррогатов, так как он является намного дешевле пищевого варианта. Метиловый спирт еще называют техническим, его часто применяют для создания органических красителей и стекла.
Как отличить метиловый спирт знают немногие, это в принципе не странно, ведь по цвету и запаху распознать их сложно, они идентичны, а формула на бутылке не отображается. Отличия можно уловить, если у вас хорошее обоняние. Метиловый спирт обладает менее насыщенным запахом, а этил усиливает любые запахи, соответственно открыв бутылку и уловив сильный аромат, можно предположить, что там этил. К большому сожалению, различить по запаху вещество, удается немногим, соответственно и сталкиваются люди со слепотой, рвотой и приступами удушья, употребив метил.
Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир: |
Химические свойства одноатомных спиртов
Общая формула одноатомных предельных спиртов: CnH2n+1OH. В спиртах, одноатомных и многоатомных, помимо связи между углеродом и водородом (С—ОН), есть еще одна связь между кислородом и водородом (О—Н). Поэтому химические реакции проходят с разрывом одной из цепей:
-
реакции восстановления проходят с отщеплением гидроксильной группы от молекулы спирта;
-
реакции окисления — с отщеплением водорода.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Кислотно-основные свойства
Согласно теории Бренстеда-Лоури спирты — достаточно слабые кислоты. Кислотность спиртов уменьшается по мере усложнения углеродного скелета.
-
Взаимодействие со щелочными металлами:
2С2Н5ОН + 2Na → 2C2H5ONa + H2. -
Взаимодействие со щелочами:
С2H5OH + NaOH ⇄ C2H5ONa + H2O.
Спирты — более слабые кислоты, чем вода, поэтому невозможна реакция с водными растворами щелочей. Взаимодействие с твердыми щелочами возможно, реакция обратима. Равновесие сильно смещено влево.
Основность кислот увеличивается по мере увеличения углеродного скелета.
Замещение гидроксогруппы
Гидроксогруппа является плохо уходящей. Энергия разрыва связи С—О довольно высока, поэтому непосредственное замещение группы ОН на другую группу невозможно.
Для того, чтобы замещение было возможно, группу ОН превращают в хорошо уходящую, т. е. понижают энергию разрыва связи. Для этого:
-
проводят реакцию в кислой среде;
-
переводят гидроксигруппу в сульфогруппу применяя H2SO4;
-
применяют кислоты Льюиса.
R—OH + PCl5 → R—Cl + POCl3 + HCl
R—OH + SOCl2 → R—Cl + SO2 + HCl
R—OH + HCl → R—Cl + H2O
R—OH + PBr → R—Br + H3PO3
R—OH + KBr + H2SO4 → R—Br + KHSO4 + H2O
Реакция с использованием реактива Лукаса
Реактив Лукаса — это смесь ZnCl2 и HCl. Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
Быстрее всего реагируют третичные спирты, слой нерастворимого алкилгалогенида появляется фактически сразу же после смешения реагентов — меньше чем за минуту.
Вторичные спирты вначале растворяются в реактиве, но затем раствор мутнеет, в течение 5 минут появляются капли алкилгалогенида.
Растворы первичных спиртов остаются прозрачными, они образуют хлориды только при нагревании.
![]()
Дегидратация спиртов
При температуре &rt; 140°C и в присутствии серной кислоты происходит внутримолекулярная дегидратация. В результате реакции получается алкен.
![]()
При температуре < 140°C и в присутствии серной кислоты происходит межмолекулярная дегидратация. В результате образуется простой эфир.
![]()
Реакция этерификации — получение сложных эфиров
Предельные одноатомные спирты вступают в химические реакции с карбоновыми кислотами, продукты таких реакций — сложные эфиры.
![]()
Взаимодействие с аммиаком
Эта реакция происходит при нагревании и в присутствии катализатора. Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
![]()
Окисление
-
Горение спиртов:
C2H5OH + 3O2 → 2CO2 + 3H2O. -
Жидкофазное окисление с применением хромовой смеси K2Cr2O7 + H2SO4:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O. -
Окисление оксидом меди (II) при нагревании:
CH3—CH2—OH + CuO → CH3—CHO + Cu + H2O.
Первичные спирты при окислении образуют альдегиды, вторичные переходят в кетоны, третичные окисляются с разрушением углеродного скелета.
Применение
Топливо
Первым использовал этанол в качестве моторного топлива Генри Форд, который в 1880 г. создал первый автомобиль, работающий на этаноле. Возможность использования спиртов в качестве моторного топлива была показана также в 1902 г., когда на конкурсе в Париже были выставлены более 70 карбюраторных двигателей, работающих на этаноле и смесях этанола с бензином.
Этанол может использоваться как топливо, в т. ч. для ракетных двигателей (так, 75%-й водный этанол использовался в качестве топлива в первой в мире серийной баллистической ракете — немецкой «Фау-2» и ранних советских ракетах конструкции Королёва — от Р-1 до Р-5), двигателей внутреннего сгорания, бытовых, походных и лабораторных нагревательных приборов (т. н. «спиртовок»), грелок для туристов и военнослужащих (каталитическое автоокисление на платиновом катализаторе). Ограниченно (в силу своей гигроскопичности) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — Этил-трет-бутилового эфира, более независимого от ископаемой органики, чем МТБЭ.
Химическая промышленность
- служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
- широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
- является компонентом антифризов и стеклоомывателей;
- в бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина
![]()
В медицине этиловый спирт в первую очередь используется как растворитель, экстрагент и антисептик См. также: Медицинский антисептический раствор
- по своему действию этиловый спирт можно отнести к антисептикам;
- как обеззараживающее и подсушивающее средство, наружно;
- подсушивающие и дубящие свойства 97%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
- растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
- консервант настоек и экстрактов (минимальная концентрация 18 %);
- пеногаситель при подаче кислорода, искусственной вентиляции лёгких;
- в согревающих компрессах;
- для физического охлаждения при лихорадке (для растирания);
- компонент общей анестезии в ситуации дефицита медикаментозных средств;
- как пеногаситель при отёке лёгких в виде ингаляции 33 % раствора;
- этанол является противоядием при отравлении некоторыми токсичными спиртами, такими, как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты).
Парфюмерия и косметика
Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая зубные пасты, шампуни, средства для душа, и т. д.
Пищевая промышленность
Наряду с водой, является основным компонентом спиртных напитков (водка, вино, джин, пиво и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1—3 % этанола (в крепком до 4,5 %), в квасе — от 0,5 до 1,2 %.
Растворитель для пищевых ароматизаторов. Может быть использован как консервант для хлебобулочных изделий, а также в кондитерской промышленности.
Зарегистрирован в качестве пищевой добавки E1510
Энергетическая ценность этанола — 7,1 ккал/г.
Получение
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена).
Брожение
См. также: Биоэтанол § Брожение
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала картофеля, риса, кукурузы. Источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её результат можно выразить уравнением:
C6H12O6 → 2C2H5OH + 2CO2
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путём дистилляции.
Для получения этанола этим способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae, в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.
Промышленное производство спирта из биологического сырья
Современная промышленная технология получения этилового спирта из пищевого сырья включает следующие стадии:
- Подготовка и измельчение крахмалистого сырья — зерна (прежде всего — ржи, пшеницы), картофеля, кукурузы, яблок и т. п.
- Ферментация. На этой стадии происходит ферментативное расщепление крахмала до сбраживаемых сахаров. Для этих целей применяются рекомбинантные препараты альфа-амилазы, полученные биоинженерным путём — глюкамилаза, амилосубтилин.
- Брожение. Благодаря сбраживанию дрожжами сахаров происходит накопление в браге спирта.
- Брагоректификация. Осуществляется на разгонных колоннах.
Отходами бродильного производства являются углекислый газ, барда, эфиро-альдегидная фракция, сивушный спирт и сивушные масла.
Спирт, поступающий из брагоректификационной установки (БРУ), не является безводным, содержание этанола в нём до 95,6 %. В зависимости от содержания в нём посторонних примесей, его разделяют на следующие категории:
- Альфа
- Люкс
- Экстра
- базис
- высшей очистки
- 1 сорт
Производительность современного спиртового завода составляет около 30 000—100 000 литров спирта в сутки.
Гидролизное производство
Основная статья: Гидролизный спирт
В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу (древесина, солома), которую предварительно гидролизуют. Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР (ныне в России) существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
Гидратация этилена
В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
CH2 = CH2 + H2O → C2H5OH
гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):
CH2 = CH2 + H2SO4 → CH3CH2OSO2OH CH3CH2OSO2OH + H2O → CH3CH2OH + H2SO4 Эта реакция осложняется параллельной реакцией образования диэтилового эфира.
Очистка этанола
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95,6 % (мас.); эта неразделимая перегонкой азеотропная смесь содержит 4,4 % воды (мас.) и имеет температуру кипения 78,15 °C.
Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт — этиловый спирт, практически не содержащий воды. Он кипит при температуре 78,39 °C, в то время как спирт-ректификат, содержащий не менее 4,43 % воды, кипит при 78,15 °C. Получают перегонкой водного спирта, содержащего бензол, и другими способами, например, спирт обрабатывают веществами, реагирующими с водой или поглощающими воду, такими, как негашёная известь CaO или прокалённый медный купорос CuSO4.
Что такое B2B, B2C, C2C? – ДеньгоДел.com
В мировой экономике и бизнесе существует взаимодействие между их субъектами. В бизнесе присходит взаимодействие производителя или продавца товаров или услуг и его клиентов. Есть другие модели.
B2B
![]()
От англ. «business to business». Бизнес для бизнеса. Эта бизнес-модель – форма взаимодействия двух организаций. Не работает на потребителей. Одна организация создаёт, продает, сдает в аренду или лизинг материальные объекты другой организации. Вторая — продаёт, перерабатывает с помощью первой компании. Но главная цель этого — получения прибыли.
Примеры:
1) производство барно-ресторанного оборудования. Организации производства оборудования продают его другим компаниям, а не конечным покупателям. Нужна ли барная стойка дома? А вот ресторану, кафе или бару без неё не извлечь прибыль. Любые производства оборудования для другого бизнеса – часть B2B рынка;
2) рекламные агентства. Фирмам и организациям нужна реклама. Рекламные агентства выполняют услуги другим компаниям, помогающие в построении предпринимательской деятельности. Рекламные агентства работают на те компании, которые они рекламируют (их товары, проекты) и не работают на конечных потребителях продукта, то есть рекламы.
3) консалтинговые компании. Консалтинг – консультации в финансовой, экономической, юридической сферах для других компаний. Они же являются клиентами. У консалтинговых компаний нет прямой взаимосвязи с потребителями услуг своих клиентов, поэтому они и относятся к B2B бизнесу.
Крупные и известные компании в сфере B2B: IBM, Oracle, Intel, General Electric, Роснефть.
B2C
От англ. «business to consumer». Бизнес для потребителя. Основа такой формы – взаимоотношения между организацией и частными лицами. B2C продают товары или услуги, которые предназначаются непосредственно для потребителей, использующие их в своих личных целях.
Примеры:
2) юридические компании. Фирмы, предоставляющие юридические услуги частным клиентам, относятся к B2C бизнесу. Это могут быть нотариальные услуги, оформление сделок, составление договоров. Но только в том случае, когда конечным потребителем является частное лицо и используются эти услуги в личных целях — например, человек, захотевший оформить завещание. Есть юридические компании, работающие и в секторе B2B, например, юридическое сопровождение бизнеса.
Крупные и известные компании в сфере B2C: Dell, Ikea, Inditex, Wal-Mart, Starbucks.
![]()
C2C
От англ. «consumer-to-consumer». Потребитель для потребителя. Обозначает схему электронной торговли конечного потребителя с конечным потребителем.
В этом процессе участвует третья сторона – торговая площадка, на которой происходит эта продажа.
Примеры:
1) веб-порталы с объявлениями о купле-продаже. Сам портал является той самой третьей стороной, которая обеспечивает условия для осуществления взаимодействия.
2) интернет-аукционы. Аукцион – это торговая площадка, где частные лица – потребители – покупают или продают различные вещи. К сфере C2C будет относиться именно взаимодействие продавцов и покупателей;
3) печатные газеты с объявлениями.
Крупные и известные площадки: Ebay, Craigslist, Gumtree, Avito.
Химические свойства
Для спиртов можно выделить следующие реакции:
- Кислотно-основные;
- Дегидратация спиртов;
- Нуклеофильное замещение гидроксильной группы;
- Окисление спиртов.
Кислотные и основные свойства. Спирты способны проявлять себя как кислоты и как основания. Кислотность спиртов определяется строением алкильного радикала. Основные свойства спиртов проявляются по отношению к протонным и апротонным кислотам. Донором электронов в молекуле спирта является атом кислорода.
Взаимодействие с неорганическими кислотами. Спирты взаимодействуют с кислородсодержащими минеральными кислотами, реакция приводит к образованию сложных эфиров неорганических кислот. Многоосновные кислоты при взаимодействии со спиртами образуют кислые и средние эфиры. Высшие спирты, особенно вторичные и третичные, под действием серной кислоты легко образуют алкены и не образуют эфиров в таких условиях.
Дегитратация спиртов. Спирты вступают в реакции дегидратации (отщепление воды). Реакции отщепления протекают по внутримолекулярному и межмолекулярному типу с отщеплением воды и получением алкенов и простых эфиров.
Так, если этанол нагреть выше 170 ° С в присутствии концентрированной серной кислоты, происходит реакция внутримолекулярной дегидратации. Спирт превращается в ненасыщенный углеводород этилен: C2H5OH → CH2 = CH2 + H2O.
Если этанол нагреть только до температуры 140 ° С в присутствии концентрированной серной кислоты, происходит реакция межмолекулярного дегидратации. В результате ее образуются диэтиловый эфир и вода: C2H5OH + HOC2H5 → C2H5 — O — C2H5 + H2O.
Нуклеофильное замещение гидроксильной группы. К реакциям нуклеофильного замещения относятся замещение гидроксильной группы на галоген, амино-, алкоксигруппу и др. Гидроксид-анион, который выступает в роли уходящей группы, относится к числу трудно замещаемых групп. Чтобы осуществить нуклеофильное замещение гидроксильной группы в спиртах, последние необходимо модифицировать таким образом, чтобы гидроксид-анион не выступал в роли уходящей группы. Часто реакции проводят в присутствии сильных кислот, в этом случае гидроксильная группа протонируется и отщепляется в виде молекулы воды.
Реакции замещения спиртов протекают с образованием солей (алкоголятов и гликолятов металлов), сложных эфиров (этерификация с минеральными и карбоновыми кислотами), галогенопроизводных (гидрогалогенирование).
При окислении спиртов образуются оксосоединения (альдегиды и кетоны). Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот. При окислении вторичных спиртов образуются кетоны.
Спирты, как и все органические соединения, горят. Метанол и этанол мгновенно загораются при поджигании и горят синеватым, почти незаметным пламенем с выделением большого количества теплоты. Происходит реакция полного окисления, продуктами которой являются CO2 и H2O.
Классификация спиртов
В зависимости от количества гидроксильных групп в молекуле спирты делят на:
- одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
- многоатомные (две и более гидроксильных групп), например, этиленгликоль, глицерин.
По тому, с каким числом радикалов связан атом углерода, соединенный с группой ОН— спирты делят на:
- первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен красным цветом), связанный всего с одним углеродным атомом. Примеры первичных спиртов – этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH.
- вторичные, у которых ОН-группа связана с вторичным атомом углерода. Вторичный атом углерода (выделен синим цветом) связан одновременно с двумя атомами углерода, например, вторичный пропанол, вторичный бутанол.
- третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный углеродный атом (выделен зеленым цветом) связан одновременно с тремя соседними атомами углерода, например, третичный бутанол и пентанол.
![]()
По характеру связей радикала спирты бывают предельными, непредельными, ароматическими, алифатическими. В ароматических спиртах гидроксил связан не напрямую с бензольным кольцом, а через другой (другие) радикалы.
![]()
Соединения, в которых ОН— прямо связана с бензольным циклом, считаются отдельным классом фенолов.